在活體細胞內修飾蛋白的工具: 具蛋白選擇性,位置選擇性,及色胺酸專一性的釕錯合物多肽光親合反應
A Toolkit for Engineering Proteins in Living Cells: Peptide with a Tryptophan-Selective Ru-TAP Complex to Regioselectively Photolabel Specific ProteinsJ. Am. Chem. Soc. 2022, 144, 39, 18117-18125
Tzu-Ho Chen, Kevin Garnir, Chong-Yan Chen, Cheng-Bang Jian, Hua-De Gao, Bill Cheng, Mei-Chun Tseng, Cécile Moucheron, Andrée Kirsch-De Mesmaeker*, and Hsien-Ming Lee*
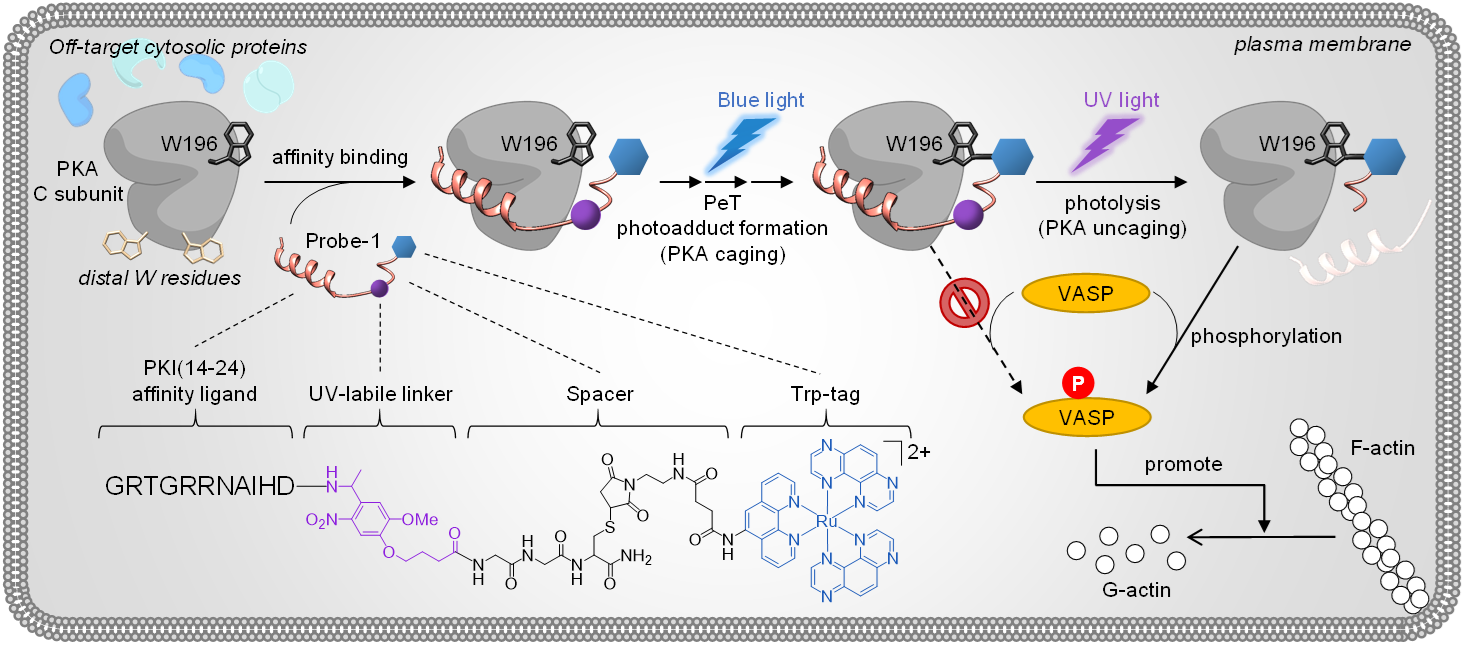
The chemical modification of proteins is very different from general organic chemistry. It is necessary to consider whether the protein is still active after modification. Therefore, a fairly "soft" biocompatible aqueous chemical reaction condition is required, with appropriate pH and salt concentration, and without organic solvents. This makes the "window" of the chemical reaction become very narrow. Moreover, there are only few natural amino acid side chain chemistries available for protein modification/conjugation. This also drastically slows down the developments of protein modification chemistries. Therefore, new chemistry suitable for side chain modification is very important in chemical biology. If the chemistry is cyto-compatible (kinda like biorthogonal), it is possible for protein to be directly modified in living cells. In recent years, some research groups have developed new aqueous side chain chemistries suitable for protein modification. These amino acid side chain chemistries are relatively inert with less abundance in proteins, such as histidine (aromatic amines), tyrosine (aromatic alcohols), methionine (methyl thiol). However, those reaction conditions are not cytocompatible. Herein, we report a cytocompatible and highly chemo-/regio-/protein-selective photolabeling strategy using a tryptophan-specific Ru-TAP complex as a photocrosslinker, as a proof of concept. Aside from the high selectivity, the photolabeling is blue light-driven by a photoinduced electron transfer (PeT) and allows the bioeffector to bear an additional UV-responsive unit. The two different photosensitivities are demonstrated by conjugating a blue light-photocrosslinking and a UV-cleavable peptide to protein of interest. Our visible light photolabeling can generate photocaged proteins for subsequent activity manipulation by UV light. Cytoskeletal dynamics regulation is demonstrated in living cells via the unprecedented POI photomanipulation and proves that our methodology opens a new avenue to endogenous protein modification.
把細胞當成試管,在活體細胞中直接進行單一特異內源性蛋白質化學修飾反應,可以達到以化學策略進行對細胞的信號傳遞甚至行為控制,造成有效的干預效果。概念簡單粗暴,但做起來並不容易。這種化學反應必須要有非常高的選擇性(包含蛋白質選擇性,胺基酸側鍊化學選擇性,及胺基酸位置選擇性)。為了顧及到蛋白質修飾後必須仍具有活性,不可讓蛋白變性失效,需要相當 ”軟性” 的水相化學反應。而且為了不讓這個化學反應干擾活體細胞內其他各種複雜生物化學反應運作,還必須高度要求細胞相容性且不干擾細胞其他生物化學反應(可以先把它想成需要類似生物正交性)。這使得這類化學反應的"窗口"非常的小。常見的硫醇側鏈的半胱胺酸或胺基側鏈的離胺酸的化學修飾的位置選擇性太差,也無法修飾特定蛋白。目前針對含量較低且較惰性的胺基酸開發的修飾化學,則提供了更多的化學選擇性,如針對組胺酸,酪胺酸,甲硫氨酸側鍊的修飾。較有名的例子如 2021 年諾貝爾化學獎得主 MacMillan一 系列利用光催化反應修飾蛋白側鏈化學。不過上述這類反應因為胺基酸側鍊較惰性,反應條件因此較嚴苛,不太細胞相容,同時仍然缺乏蛋白質專一性,因此僅適合試管內修飾單一蛋白,而非活體細胞內蛋白。2022 諾貝爾獎的生物正交點擊化學,若要應用在活體細胞內修飾專一蛋白的話,必須先利用非天然胺基酸插入表現蛋白的基因工程,在細胞內製造出含有點擊化學需要的非天然胺基酸側鍊正交官能基的蛋白質,再進行化學修飾。然而"先基因工程再化學修飾"的方法,工程過於浩大。因此必須捨棄化學選擇性達到蛋白選擇性。另一方向則可藉由親合配體修飾(affinity ligand-directed labeling) 改善達到蛋白選擇性。然而傳統自由基和碳烯 (carbene) 的親和配體光化學修飾法 (photoaffinity labeling) 沒有側鍊或化學選擇性,僅能保持蛋白選擇性。加上親和配體通常都瞄準蛋白活性區,周圍的 C–C, C–H, O–H and X–H 都有可能隨機發生光誘發插入反應後,對被修飾的蛋白活性有很大程度負面影響。因此這類技術通常用於在試管中的蛋白混和物中如細胞濾液釣取 (enrich) 所要蛋白,而不是在活細胞內反應。Hamachi 的親和配體化學,以親和配基造成的鄰近效應來降低脫靶副反應,達成準生物正交性。可以用在活細胞內外,但胺基酸側鍊化學選擇性仍不夠專一,修飾後蛋白為混合物。本工作結合光親合反應和 Hamachi 反應的優勢,利用 Ruthemium-TAP complex 與色胺酸(tryptophan)側鍊的吲哚 (indole) 進行有化學選擇性的藍光誘發電子轉移 (photo-induced electron transfer) 成鍵的光化學親和反應。此反應兼具蛋白質選擇性,特異胺基酸位置及化學選擇性,產物為單一修飾蛋白。比起傳統紫外光親和反應光,較長波長的光源誘導,更可增加生物及細胞相容性。 上述所進行的化學修飾也有別於傳統單調功能性修飾(如加上螢光團或 biotin)。本工作選擇加上一段可紫外光解斷鍵的多肽,直接控制被修飾蛋白 protein kinase A (PKA) 活性。所以此工作中,照藍光即可成功化學修飾蛋白並使其停止工作,等到所要的時間點來臨後,可再照紫外光斷鍵以還原蛋白活性。所以是由不同波長(顏色)的光源,來控制所有反應。除了以試管內蛋白實驗證明蛋白選擇性,活性可控性,並以質譜證明側鍊及位置專一性之外,並顯微注射到活體細胞內,以不同顏色光照,進行活體細胞PKA蛋白修飾,並進行細胞信號傳遞的干預。
