黃人則老師研究團隊的主要研究目標包括了(一) 闡明蛋白質聚集體在神經退化性疾病致病機轉中所扮演的角色,(二) 合成治療神經退化性疾病的胜肽藥物,並且同時發展新穎的小分子藥物,(三) 合成用於神經退化性疾病診斷與病程追蹤的光控奈米探針,以及(四)開發高度生物相容性的水凝膠,作為組織工程與再生醫學的應用。
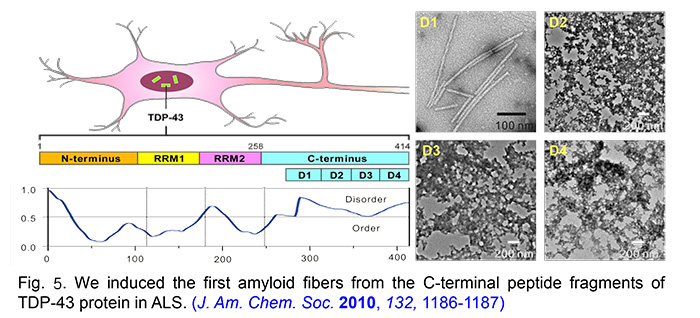
在許多神經退化性疾病的細胞中,經常發現不正常蛋白質聚集體的存在。這些聚集體具有纖維狀結構,富含 β 摺板的二級結構。然而,這些聚集體的分子形成機制,以及它們在細胞層次上對疾病進程的影響,仍需深入探討。TDP-43 蛋白質被認為是肌萎縮性側索硬化症 (ALS;漸凍人) 和額顳葉退化症 (FTLD) 的致病因子。黃老師團隊的研究顯示,含有 TDP-43 蛋白質 C 端特定片段序列的胜肽,能透過晶種效應加速 TDP-43 的聚集,並形成纖維狀聚集體。
目前,團隊透過合成具「光控制性質」的胜肽,結合即時細胞影像技術,發展一套化學生物學工具,用以探討 TDP-43 及其他神經退化性疾病相關致病蛋白(如杭丁頓氏舞蹈症中的 Huntingtin)的詳細特性與行為。這些光控制胜肽在適當波長的光照射下會斷裂,並開始自組裝聚集化,或誘導其他細胞內蛋白質聚集。透過準確調控光照的時間點及空間範圍,我們能更深入研究這些聚集體在相關疾病中的角色。具體研究方向包括:
- 光控制胜肽的設計與合成
- 新穎螢光染劑的開發
- 利用神經細胞株/人類誘導幹細胞研究特定蛋白質在疾病中的角色
- 結合奈米科學,將胜肽修飾於奈米粒子表面,開發高效胜肽藥物輸送方式及生物感測器
除了上述研究主題外,我們也專注於開發新型胜肽水凝膠。水凝膠因其高度生物相容性及類似細胞外基質 (ECM) 的結構特性,在醫療與生物工程領域中應用廣泛,例如神經修復、藥物釋放及三維細胞培養。實驗室透過扎實的胜肽設計、胜肽合成與化學修飾能力,並開發出一系列新型胜肽水凝膠。該水凝膠具備獨特的自組裝特性,能依據環境條件形成穩定的三維結構。這些胜肽水凝膠結合材料工程與生物醫學的優勢,為細胞培養和組織修復提供了更具潛力的平台。
- "The 2019 Career Development Award (中研院前瞻計畫)" (2019)
- "Award received from the Taiwan Motor Neuron Disease Association(第三屆漸凍人研究獎)" (2018)
- "Ministry of Science and Technology Research Project for Excellent Young Scholars(科技部優秀年輕學者研究計畫)" (2017)
- "2012 Excellent Young Scholar Award (2012年中國化學會傑出青年化學獎章)" (2012-12)
- "Taiwan Merit Scholarship(菁英專案擴增留學計畫獎助)" (2005, 2006, 2007)
- "台灣大學理學院院長獎" (2004-07)
- "第八屆生物物理年會壁報論文比賽第一名" (2002-05)
-
JOURNAL ARTICLES:
- Chuang, H.-Y.; He, R.-Y.; Huang, Y.-A.; Hsu, W.-T.; Cheng, Y.-J.; Guo, Z.-R.; Niaz Wali, Hwang, I-S.; Shie, J.-J.; Huang, J. J.-T.* Engineered droplet-forming peptide as photocontrollable phase modulator for fused in sarcoma protein. Nature Communications 2024, 15(1), 5686-5698.
- Tseng, Y.-L., Lu, P.-C., Lee, C.-C., He, R.-Y., Huang, Y.-A., Tseng, Y.-C., Cheng, R. T.-J., Huang, J. J.-T.*,Fang, J.-M.* Degradation of neurodegenerative disease-associated TDP-43 aggregates and oligomers via a proteolysis-targeting chimera. J. Biomed. Sci. 2023, 30, 27.
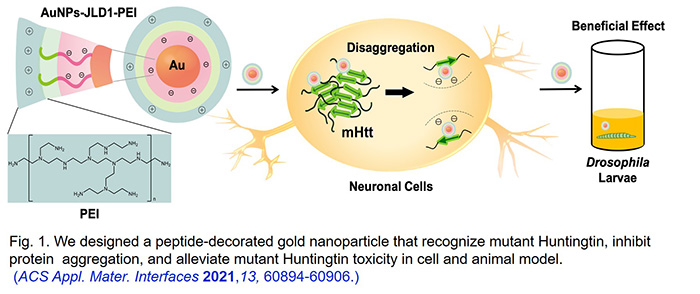
- Wahyuningtyas, D.; Chen, W.-H.; He, R.-Y.; Huang, Y.-A.; Tsao, C.-K.; He,Y.-J.; Yu,C.-Y.; Lu, P.-C.; Chen,Y.-C.; Wang, S.-H.; Ng, K.-C.; Chen, P.-W.; Wei, P.-K.; Shie, J.-J.; Kuo, C.-H.; Sun,Y.-H.; Huang, J. J.-T.* Polyglutamine-Specific Gold Nanoparticle Complex Alleviates Mutant Huntingtin-Induced Toxicity. ACS Appl. Mater. Interfaces 2021, 13, 60894−60906.
- Chien, H. -M.; He, R. -Y.; Lee, C. -C.; Huang, Y. -A.; Hung, I. -J.; Hou, K. -T.; Hsiao, J. -C.; Lu, P. -C.; Agnihotri, D.; Hwang, E.; Huang, J. J.-T.* Nanoscopic investigation of C9orf72 poly-GA oligomers on nuclear membrane disruption by photoinducible platform. Commun. Chem. 2021, 4, 111.
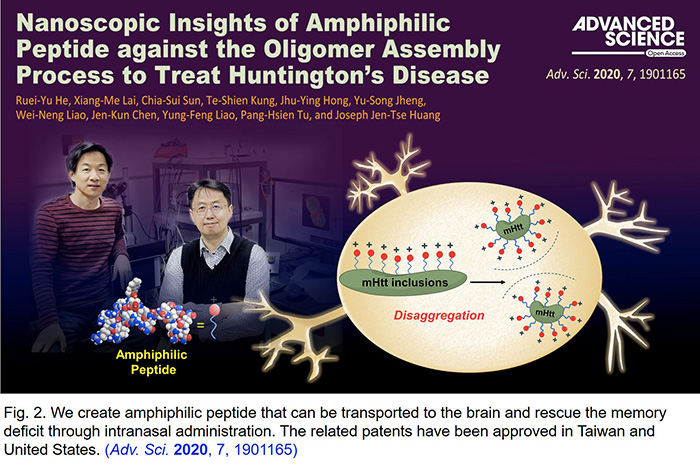
- He, R.-Y.; Lai, X.-M.; Sun, C. -S; Kung, T.-S.; Hong, J.-Y.; Jheng, Y.-S.; Liao, W. -N.; Chen, J. -K.; Liao, Y. -F.; Tu, P. -H.; Huang, J. J. -T. Nanoscopic insights of amphiphilic peptide against oligomer assembly process to treat Huntington’s disease. Adv. Sci. 2020, 7, 1901165.
- Wahyuningtyas, D.; Chen, W.-H.; Huang, C.-H.; He, Y.-J.; Huang, J.J-T. Biocompatible Inhibitor Based on Chitosan and Amphiphilic Peptide against Mutant Huntingtin Toxicity. ChemBioChem 2019, 20, 2133-2140. (Cover Article)
- Lee, C.-C.; He, R.-Y.; Huang, J.J-T. Learning from the TDP-43 amyloidogenic sequences in neurodegenerative diseases. Amyloid 2019, 26, 154-155.
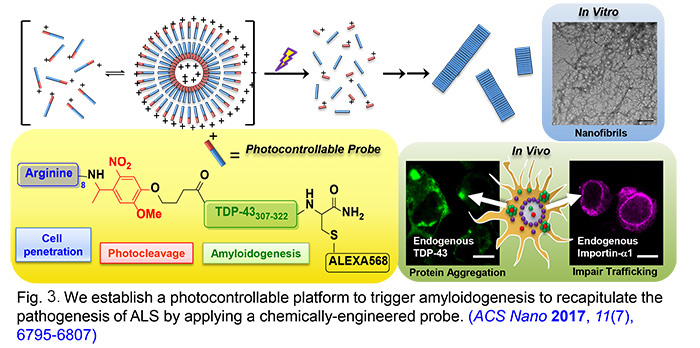
- He, R.-Y.; Chao, S.-H.; Tsai, Y.-J.; Lee, C.-C.; Yu, C.-Y.; Gao, H.-D.; Huang, Y.-A.; Hwang, E.; Lee, H.-M.; Huang, J. J-T. Photo-Controllable Probe Spatiotemporally Induces Neurotoxic Fibrillar Aggregates and Impairs Nucleocytoplasmic Trafficking. ACS Nano 2017, 11 (7), 6795-6807.
- Du, Y.-P.; Chang, H.-H.; Yang, S.-Y.; Huang, S.-J.; Tsai, Y.-J.; Huang, J..J.-T.; Chan, J.-C. Study of Binding Interaction between Pif80 Protein Fragment and Aragonite. Sci. Rep. 2016, 6, 30883.
- Chen, C-H.; Khan, A.; Huang, J. J.-T.; Ulmschneider, M.-B. Mechanisms of membrane-pore formation by amyloidogenic peptides in ALS.Chem. Eur. J. 2016, 22, 9958-9961.
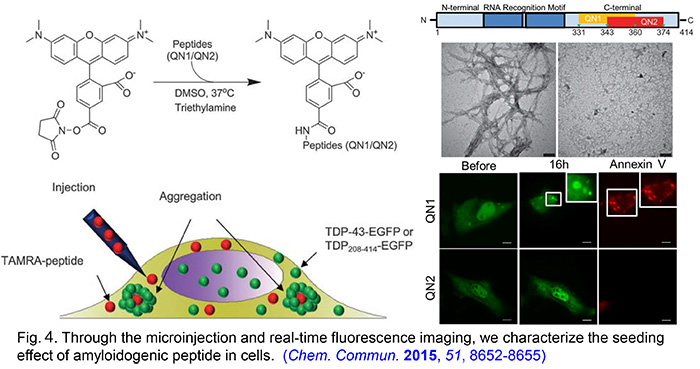
- He, R.-Y.; Huang, Y.-C.; Chiang, C.-W.; Tsai, Y.-J.; Ye, T.-J.; Gao, H.-D.; Wu, C.-Y.; Lee, Y.-M.; Huang, J. J.-T. Characterization and real-time imaging of the FTLD-related protein aggregation induced by amyloidogenic peptides. Chem. Commun. 2015, 51, 8652.
- Sun, C.-S. ; Lee, C.-C.; Li, Y-N; Yang S. Y.-C.; Lin, C.-H.; Chang, Y.-C.; He, R.-Y.; Liu, P.-F.; Wang ,C.-H.; Chen, W.; Chern, Y.; Huang J. J.-T. Conformational switch of polyglutamine-expanded huntingtin into benign aggregates leads to neuroprotective effect. Sci. Rep. 2015, 5, 14992. (Recommended in F1000Prime by F1000 faculty member)
- Huang C.-C.; Bose J.-K.; Majumder P.; Lee K.-H., Huang, J. J.-T.; Huang J. K.; Shen J. C.-K. Metabolism and mis-metabolism of the neuropathological signature protein TDP-43. J. Cell Sci. 2014, 127(Pt 14), 3024..
- Liu, G. C.-H.; Chen, B. P.-W.; Ye, N. T.-J.; Wang, C.-H.; Chen, W.; Lee, H.-M.; Chan, S. I., Huang, J. J.-T. Delineating the membrane-disrupting and seeding properties of the TDP-43 amyloidogenic core. Chem. Commun. 2013, 49, 11212.
(Highlighted in Significant Research Achievements of Academia Sinica 2013)
- Huang, J. J.-T.; Larsen, R.-W.; Chan, S.-I. The Interplay of Turn Formation and Hydrophobic Interactions on the Early Kinetic Events in Protein Folding. Chem. Comm. 2012, (Feature Article), 48, 487.
-
Chen, K.-H.; Lin, Y.-Y.; Xie, Z.-J.; Tu, P.-H.; Chen, P.-Y.; Liao, T.-Y.; Huang, J. J.-T. Induction of Amyloid Fibrils by the C-terminal Fragments of TDP-43 in Amyotrophic Lateral Sclerosis. J. Am. Chem. Soc. 2010, 132, 1186.
(Highlighted in Significant Research Achievements of Academia Sinica 2010)
(Selected in 2010 Science and Technology Yearbook of Republic of China)
- Kuo, N. N.-W.; Huang, J. J.-T.; Miksovska, J.; Chen, P.-Y.; Larsen, R.; Chan, S. I. Effects of turn stability on the kinetics of refolding of a hairpin in b-sheet. J. Am. Chem. Soc. 2005, 127, 16945.
- Chen, R. P. Y.; Huang, J. J.-T.; Chen, H. L.; Jan, H.; Velusamy, M.; Lee, C. T.; Fann, W. S.; Larsen, R. W.; Chan, S. I. Measuring the refolding of beta-sheets with different turn sequences on a nanosecond time scale. Proc. Natl. Acad. Sci. U. S. A. 2004, 101, 7305.
- BOOK CHAPTER:
-
Chan, S. I.; Huang, J. J.-T.; Larsen, R. W.; Rock, R. S.; Hansen, K. C. Early kinetic events in protein folding: The development and applications of caged peptides in dynamic studies in biology. phototriggers, photoswitches, and caged biomolecules; Goeldner, M. and Givens. R. (eds), Wiley-VCH GmbH & Co. Germany, 2005, pp479.
Update: 2024-11-14
- Diksha Agnihotri; Lee ,C.-C.; Lu, P.-C.; He, R.-Y.; Huang, Y.-A.; Kuo, H.-C.; Huang, J. J.-T.* C9ORF72 poly-PR induces TDP-43 nuclear condensation via NEAT1 and is modulated by HSP70 activity. Cell Reports 2025-1, 44(1), 115173.
- Liu, Y.-J.; Lee, C.-W.; Liao, Y.-C.; Huang, J. J.-T., Kuo, H.-C.; Jih, K.-Y.; Lee, Y.-C.; Chern, Yijuang* The role of adiponectin-AMPK axis in TDP-43 mislocalization and disease severity in ALS. Neurobiology of Disease 2024-11, 202, 106715.
- Chuang, H.-Y.; He, R.-Y.; Huang, Y.-A.; Hsu, W.-T.; Cheng, Y.-J.; Guo, Z.-R.; Niaz Wali, Hwang, I-S.; Shie, J.-J.; Huang, J. J.-T.* Engineered droplet-forming peptide as photocontrollable phase modulator for fused in sarcoma protein. Nature Communications 2024, 15(1), 5686-5698.
- Tseng, Y.-L.; Lu, P.-C.; Lee, C.-C.; He, R.-Y.; Huang, Y.-A.; Tseng, Y.-C.; Cheng, R. T.-J.; Huang, J. J.-T.*; Fang, J.-M.* Degradation of neurodegenerative disease-associated TDP-43 aggregates and oligomers via a proteolysis-targeting chimera. JOURNAL OF BIOMEDICAL SCIENCE 2023, .
- Chen, B. P.-W., He, R.-Y., Chien, H.-M., Lee, C.-C., Hsu, C.-P., Chan, J .C.-C., Huang, J. J.-T.* Superresolution Imaging of Photochromic Acylhydrazone Moieties on Amyloid Nanofibrils: Implications for Photoswitchable Probes.. ACS APPLIED NANO MATERIALS 2022-01, 5(2), 1734-1739.
- Wahyuningtyas, D., Chen, W.-H., He, R.-Y., Huang, Y.-A., Tsao, C.-K., He, Y.-J., Yu, C.-Y., Lu, P.-C., Chen, Y.-C., Wang, S.-H., Ng, K.-C., Chen, P.-W., Wei, P.-K., Shie, J.-J., Kuo, C.-H., Sun, Y.-H., Huang, J. J.-T.* Polyglutamine-Specific Gold Nanoparticle Complex Alleviates Mutant Huntingtin-Induced Toxicity. ACS APPLIED MATERIALS & INTERFACES 2021-12, 13, 60894-60906.
- Chien, H.-M., He, R.-Y., Lee, C.-C., Huang, Y.-A., Hung, I.-J., Hou, K.-T., Hsiao, J.-C., Lu, P.-C., Agnihotri, D., Hwang, E., Huang, J. J.-T.* Nanoscopic investigation of C9orf72 poly-GA oligomers on nuclear membrane disruption by photoinducible platform. Communications Chemistry 2021-07, 4(111), 1-13.
- Chien, H.-M., Lee, C.-C., Huang, J. J.-T.* The Different Faces of the TDP-43 Low-Complexity Domain: The Formation of Liquid Droplets and Amyloid Fibrils. INTERNATIONAL JOURNAL OF MOLECULAR SCIENCES 2021-07, 22(15), 8213.
- He, R. -Y.*, Lai, X.-M., Sun, C. -S, Kung, T.-S., Hong, J.-Y., Jheng, Y.-S., Liao, W. -N., Chen, J. -K., Liao, Y. -F., Tu, P. -H.*, Huang, J. J.-T.* Nanoscopic insights of amphiphilic peptide against oligomer assembly process to treat Huntington’s disease. ADVANCED SCIENCE 2019-12, 1901165.
- Lee, C.-C.,He, R.-Y., Huang, J.J-T.* Learning from the TDP-43 amyloidogenic sequences in neurodegenerative diseases. AMYLOID-JOURNAL OF PROTEIN FOLDING DISORDERS 2019-07-25, 26, 154-155..
- Wahyuningtyas, D., Chen, W.-H., Huang, C.-H., He, Y.-J., Huang, J.J-T.* Biocompatible Inhibitor Based on Chitosan and Amphiphilic Peptide against Mutant Huntingtin Toxicity. CHEMBIOCHEM 2019-06, 20(16), 2133-2140..
- He, R.-Y., Chao, S.-H., Tsai, Y.-J., Lee, C.-C., Yu, C.-Y., Gao, H.-D., Huang, Y.-A., Hwang, E., Lee, H.-M., Huang, J.J-T.* Photo-controllable probe spatiotemporally induces neurotoxic fibrillar aggregates and impairs nucleocytoplasmic trafficking. ACS Nano 2017-08, 11 (7), 6795-6807.
- Koubek, J., Chang, Y.-C., Yang, S.Y.-C., Huang, J.J-T.* Trigger factor-induced nascent chain dynamics changes suggest two different chaperone-nascent chain interactions during translation. JOURNAL OF MOLECULAR BIOLOGY 2017-07, 429(11),1733-1745.
- Du, Y.-P., Chang,H.-H., Yang, S.-Y., Huang, S.-J., Tsai, Y.-J., Huang,J.J.-T.,Chan,J.C.-C. Study of Binding Interaction between Pif80 Protein Fragment and Aragonite. SCIENTIFIC REPORTS 2016, 6,30883.
- Chen, C.-H. , Khan, A. , Huang, J. J.-T. , Ulmschneider, M.-B.* Mechanisms of membrane-pore formation by amyloidogenic peptides in ALS. CHEMISTRY-A EUROPEAN JOURNAL 2016, 22, 9958-9961.
- Sun, C.-S. , Lee, C.-C., Li, Y-N, Yang S. Y.-C., Lin, C.-H., Chang, Y.-C., He, R.-Y. , Liu, P.-F., Wang ,C.-H., Chen, W. , Chern, Y., Huang, J. J.-T.* Conformational switch of polyglutamine-expanded huntingtin into benign aggregates leads to neuroprotective effect.. Scientific Reports 2015, 5,14992.
- Koubek, J., Chen, Y.-R., Cheng, R.-P.,Huang, J.J.-T.* Nonorthogonal tRNA(cys, Amber) for protein and nascent chain labeling. RNA 2015, 21,1672-1682.
- He, R.-Y., Huang, Y.-C., Chiang, C.-W., Tsai, Y.-J., Ye, T.-J., Gao, H.-D., Wu, C.-Y., Lee, Y.-M., Huang, J.J.-T.* Characterization and real-time imaging of the FTLD-related protein aggregation induced by amyloidogenic peptides. CHEMICAL COMMUNICATIONS 2015, 51, 8652-8655.
- Huang, C.-C., Bose, J.-K., Majumder, P., Lee, K.-H., Huang, J. J.-T., Huang, J.-K., Shen, C.-K.*. Metabolism and mis-metabolism of the neuropathological signature protein TDP-43. Journal of cell science 2014, 127(Pt 14), 3024-38.
- Sun, C.-S., Wang, C.-Y., Chen, B.-P., He, R.-Y., Liu, G. C.-H., Wang, C.-H., Chen, W., Chern. Y., Huang, J. J.-T.* The Influence of Pathological Mutations and Proline Substitutions in TDP-43 Glycine-Rich Peptides on Its Amyloid Properties and Cellular Toxicity. PloS one 2014, 9(8), e103644.
- Liu, G. C.-H., Chen, B. P.-W, Ye, N. T.-J., Wang, C.-H., Chen, W., Lee, H.-M., Chan, S.-I., Huang, J.J.-T.* Delineating the membrane-disrupting and seeding properties of the TDP-43 amyloidogenic core. CHEMICAL COMMUNICATIONS 2013-10, 49(95), 11212-4.
- Koubek, J., Lin, K.-F., Chen, Y.-R., Cheng, R.-P., Huang, J. J.-T.* Strong anion exchange fast performance liquid chromatography as a versatile tool for preparation and purification of RNA produced by in vitro transcription. RNA 2013-06, 19,1449-1459.
- Huang, Y.-C. Lin, K.-F., He, R.-Y., Tu, P.-H. Koubek, J., Hsu,Y.-C., Huang, J. J.-T.* Inhibition of TDP-43 aggregation by nucleic acid binding. PLoS One 2013-05, 8(5), e64002.
- Chang, C.-K., Wu, T.-H., Wu, C.-Y., Chiang, M.-H., Toh, E.-K., Hsu, Y.-C., Lin, K.-F., Liao, Y.-H., Huang, T.-H.*, Huang, J. J.-T.* The N-terminus of TDP-43 Promotes Its Oligomerization and Enhances DNA Binding Affinity.. BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS 2012, 425(2), 219-224.
- Lin, K.-F., Sun, C.-S., Huang, Y.-C., Chan, S.-I., Koubek, J., Wu, T.-H., Huang, J. J.-T.* Cotranslational Protein Folding within the Ribosome Tunnel Influences Trigger-Factor Recruitment. BIOPHYSICAL JOURNAL 2012, 102, 2818-2827.
- Huang, J. J.-T., Larsen, R.-W., Chan, S.-I.* The Interplay of Turn Formation and Hydrophobic Interactions on the Early Kinetic Events in Protein Folding. CHEMICAL COMMUNICATIONS 2012, 48, 487-497.
- Allan K.-H. Chen, Ryan Y.-Y. Lin, Eva Z.-J. Hsieh, Pang-Hsien Tu, Rita P.-Y. Chen,Tai-Yan Liao, Wenlung Chen, Chih-Hsien Wang, and Joseph J.-T. Huang* Induction of Amyloid Fibrils by the C-Terminal Fragments of TDP-43 in Amyotrophic Lateral Sclerosis. JOURNAL OF THE AMERICAN CHEMICAL SOCIETY 2010, 132,1186-1187.
- Jih Ru Hwu,*Joseph Jen-Tse Huang,Fu-Yuan Tsai,Shwu-Chen Tsay,Ming-Hua Hsu,Kuo Chu Hwang,Jia-Cherng Horng,Ja-an Annie Ho,Chun-Cheng Lin Photochemical Activities of N-Nitroso Carboxamides and Sulfoximides as well as Their Application to DNA Cleavage. CHEMISTRY-A EUROPEAN JOURNAL 2009, 15, 8742-8750.
- Huang, J. J.-T.*, Jhan, J.-W. Ultra-fast and Cotranslational Protein Folding. Natural Sciences Newsletter 2008, 20,50-53.
- Kirchdoerfer RN, Huang JJ, Isola MK, Cavagnero S Fluorescence-based analysis of aminoacyl- and peptidyl-tRNA by low-pH sodium dodecyl sulfate-polyacrylamide gel electrophoresis. ANALYTICAL BIOCHEMISTRY 2007, 364(1), 92-4.
- Kuo NN, Huang JJ, Miksovska J, Chen RP, Larsen RW, Chan SI Effects of turn stability on the kinetics of refolding of a hairpin in a beta-sheet. JOURNAL OF THE AMERICAN CHEMICAL SOCIETY 2005, 127(48), 16945-54.
- Chen RP, Huang JJ, Chen HL, Jan H, Velusamy M, Lee CT, Fann W, Larsen RW, Chan SI Measuring the refolding of beta-sheets with different turn sequences on a nanosecond time scale. PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF THE UNITED STATES OF AMERICA 2004, 101(19), 7305-10.
- Chan, S. I.*, Huang, J. J.-T., Larsen, R. W., Rock, R. S., Hansen, K. C., 2005, “Early kinetic events in protein folding: The development and applications of caged peptides.”, editor(s): Goeldner, M., Givens. R., Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules, pp. 479-494, Germany: Wiley-VCH GmbH & Co..
- Jen-Tse Huang*, 2018, “Identify amyloidogenic peptides in TDP-43 and create photocontrollable probes for neurodegenerative disease”, paper presented at The 10th International Peptide Symposium, Japan: The Liaison Committee of International Peptide Societies,, 2018-12-03 ~ 2018-12-07.
- Jen-Tse Huang*, 2018, “Learning from the Amyloidogenic Peptides in Amyotrophic Lateral Sclerosis ”, paper presented at The XVIth International Symposium on Amyloidosis, Kumamoto, Japan: ISA2018 program, 2018-05-26 ~ 2018-05-29.
- Jen-Tse Huang*, 2017, “Photo-Controllable Probe Spatiotemporally Induces Neurotoxic Aggregates in Neurodegenerative Disease”, paper presented at BIT’s 7th Annual World Congress of Nano Science & Technology-2017, Fukuoka, Japan: World High Technology Society (WHTS), 2017-10-24 ~ 2017-10-26.
- Jen-Tse Huang*, 2016, “Amyloidogenic Peptides and Proteins inNeurodegenerative Diseases”, paper presented at 2016 ITbM-IoC Joint Workshop on Biomolecules and Materials, Nagoya University, Nagoya, Japan: Institute of Transformative Bio-Molecules Nagoya University, 2016-11-15 ~ 2016-11-17.
- Jen-Tse Huang*, 2016, “Learning from the Amyloidogenic Peptides in the Neurodegenerative Diseases”, paper presented at KAUST-NTU-AS Workshop for Enhancing collaborations on Research and Education in Chemical and Materials Sciences and Engineering, King Abdullah University of Science and Technology, Thuwal/Saudi Arabia: King Abdullah University of Science and Technology, KAUST, 2016-04-01 ~ 2016-04-08.
- Jen-Tse Huang*, 2015, “ALS and FTLD-related protein aggregation induced by amyloidogenic peptides”, paper presented at PACIFICHEM 2015, Honolulu, Hawaii, USA: The International Chemical Congress of Pacific Basin Societies, 2015-12-15 ~ 2015-12-20.
- VJ,Joseph J.-T. Huang*, 2015, “Early recognition by SecA targets secretory protein near the ribosome exit tunnel”, paper presented at Protein synthesis and translational control, Germany: The European Molecular Biology Laboratory, 2015-09-09 ~ 2015-09-13.
- Koubek J,Joseph J.-T. Huang*, 2015, “The local and global effects of DnaK and Trigger Factor on ribosome-bound nascent chain dynamics”, paper presented at Molecular chaperones: From molecules to cells and misfolding diseases, Greece: EMBO Conference, 2015-05-08 ~ 2015-05-13.
- Jen-Tse Huang*, 2015, “From pathological to therapeutic peptides in neurodegenerative diseases”, paper presented at 分子科學前沿海峽兩岸交流會, 北京中國科學院化學研究所: 中國科學院化學研究所, 2015-04-24 ~ 2015-04-27.
- Joseph Jen-Tse Huang, 2014, “The amyloid and prion-like properties of the TDP-43 peptides in Amyotrophic Lateal Sclerosis”, paper presented at The 2nd Taiwan-Tohoku University Neuroscience Workshop for Young Scientists, Japan: The 2nd Taiwan-Tohoku University Neuroscience Workshop for Young Scientists, 2014-12-07 ~ 2014-12-10.
- He Ruei-Yu,Jen-Tse Huang*, 2014, “Synthetic Gluntamine/Asparagine-rich polypeptides from TDP-43 exhibit amyloid properties and induce prion-like aggregation in amyotrophic lateral scelerosis”, paper presented at The 2nd Taiwan-Tohoku University Neuroscience Workshop for Young Scientists, Japan: Taiwan-Tohoku University Neuroscience Workshop for Young Scientists, 2014-12-07 ~ 2014-12-10.
- Koubek J,Joseph J.-T. Huang*, 2014, “Development of cysteine-specific tRNA and tRNA synthetase for site-specific protein fluorescence labeling in co-translational protein folding studies”, paper presented at 25th tRNA Conference, Greece: Society of Biochemistry and Molecular Biology, the University of Patras, 2014-09-21 ~ 2014-09-25.
- Chia-Sui Sun, Yijuang Chern, Joseph J.-T. Huang*, 2014, “The modulation of FKBP12 on the mutant Huntintin-induced neurotoxicity and aggregation”, paper presented at The 19th Annual Conference of the Biophysical Society of ROC, National Chen Kung University, Tainan, Taiwan: Biophysical Society of R.O.C.Institute of Bioinformatics and Biosignal Transduction, CBB, National Chen-Kung University, 2014-05-07 ~ 2014-05-10.
- Gerard, Chun-Hao Liu, Bryan, Po-Wen Chen, Nancy, Ting-Juan Ye, Chih-Hsien Wang, Wenlung Chen, Hsien-Ming Lee, Sunney I. Chan, Joseph, Jen-Tse Huang*, 2014, “Delineating the membrane-disrupting and seeding properties of the TDP-43 amyloidogenic core”, paper presented at The 19th Annual Conference of the Biophysical Society of ROC, National Chen Kung University, Tainan, Taiwan: Biophysical Society of R.O.C.Institute of Bioinformatics and Biosignal Transduction, CBB, National Chen-Kung University, 2014-05-07 ~ 2014-05-10.
- Huang, J. J.-T.*, 2013, “From pathological to therapeutic peptides”, paper presented at The Hebrew University of Jerusalem, Israel - Academia Sinica Bilateral Workshop on Nanoscience and Nanotechnology, The Auditorium, 1F, Institute of Physics, Academia Sinica: Academia Sinica Research Program on Nanoscience and Nanotechnology, 2013-11-15.
- Huang, J. J.-T.*, 2013, “The Impact of co-Translational Protein Folding within the Ribosome Tunnel on Chaperone Recruiitment”, paper presented at Technologies for Medical Diagnosis and Therapy Symposium, B1 Auditorium, Inst. of Biomedical Sciences, Academia Sinica: Institute of Biomedical Sciences Academia Sinica, 2013-10-21 ~ 2013-10-22.
- Hsu, Y.-C., Lin, K.-F., Huang, J. J.-T*, 2013, “Characterization of the thermal induced fiber from TDP-43 and its association with single-stranded DNA”, 83 pages, paper presented at The 18th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2013-06-27 ~ 2013-06-29.
- Li, Y.-N., Sun, C.-S., Wu. C.-Y., Huang. J. J.-T.*, 2013, “Modulate polyglutamin protein aggregation by Trigger factor and FKBP12”, 79 pages, paper presented at The 18th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2013-06-27 ~ 2013-06-29.
- Vijayasarathy.K, Hsu Yin-Chih, Jiri Koubek, Joseph J.-T. Huang*, 2013, “Structure characterization of ATPase-chaperone-preprotein recognition in the secretory pathway”, 84 pages, paper presented at The 18th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2013-06-27 ~ 2013-06-29.
- Chang, C.-K., Chiang, M.-H., Wu, T.-H., Toh, E. K.-W., Huang, J. J.-T., Huang, T.-H.*, 2013, “Directional binding of nucleic acid to TAR DNA-binding protein (TDP-43) RRM1 domain provides insight into splicing regulation”, 69 pages, paper presented at The 18th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2013-06-27 ~ 2013-06-29.
- Huang, Y.-C., Lin, K.-F., He, R.-Y., Tu, P.-H. Koubek, J., Hsu,Y.-C., Huang, J. J.-T.* , 2013, “Inhibition of TDP-43 aggregation by nucleic acid binding”, 77 pages, paper presented at The 18th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2013-06-27 ~ 2013-06-29.
- Wu, T.-H., Chang, C.-K., Wu, C.-Y. Hsu, Y.-C., Huang, T.-H., Huang, J. J.-T.*, 2013, “C-terminal aggregation-prone domain of neurodegenerative TDP-43 is required for altering ssDNA/RNA structure”, paper presented at The 18th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2013-06-27 ~ 2013-06-29.
- Huang, J. J.-T.*, 2013, “Complementary paradigm and insight towardmodulating TDP-43 aggregation via nucleic acid binding”, paper presented at Institute for Protein Research Seminar 2013, Osaka, Japan: Institute for Protein Research, 2013-06-19 ~ 2013-06-20.
- Jen-Tse Huang*, 2013, “The different faces of the intrinsically disordered TDP-43 in Amyotrophic Lateral Sclerosis”, paper presented at Academia Sinica and UC Davis Neuroscience Symposium, University of california, San Francisco: UC Davis Neuroscience ,NPAS, 2013-04-22 ~ 2013-04-24.
- Yi-Ni Li , Chia-Sui Sun , Chu-Ya Wu , Joseph J.-T. Huang* , 2012, “The influence of molecular chaperones on the mHtt protein aggregation process”, paper presented at 2012 Annual Meeting of Chemical Society, Department of Chemistry, National Cheng-Kung University: Department of Chemistry, National Cheng-Kung University, 2012-12-01 ~ 2012-12-02.
- Yi-Chen Huang, Jen-Tse Huang*, 2012, “Exploring the roles of DNA/RNA on TDP-43 aggregation in Amyotrophic Lateral Sclerosis”, 64 pages, paper presented at The 12th Annual Meeting of the Protein Science Society of Japan, Nagoya, Japan: Protein Science Society of Japan, 2012-06-20 ~ 2012-06-23.
- Jen-Tse Huang* , 2012, “Co-translational Protein Folding: The Journey from the Ribosome Tunnel to Cellular Function”, 71 pages, paper presented at The 12th Annual Meeting of the Protein Science Society of Japan, Nagoya, Japan: Protein Science Society of Japan, 2012-06-20 ~ 2012-06-23.
- Ku-Feng Lin, Joseph Jen-Tse Huang* , 2012, “Co-translational protein folding within the ribosome tunnel influences trigger-factor recruitment”, paper presented at The 17th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2012-05-23 ~ 2012-05-25.
- Joseph Jen-Tse Huang, 2012, “The impact of mutations in TDP-43 fragments on the formation of amyloid fibers and cellular toxicity”, paper presented at The 17th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2012-05-23 ~ 2012-05-25.
- Liu, G. C.-H., Huang, J. J-T.*, 2012, “Characterization of the aggregation properties of amyloid core in the TDP-43 C-terminal fragments”, paper presented at The 17th Biophysics Conference, Institute of BioMedical Sciences, Academia Sinica: Biophysical Society of R.O.C、IBMS, Academia Sinica, 2012-05-23 ~ 2012-05-25.
- Joseph Jen-Tse Huang*, 2012, “Exploring the Co-translational Protein Folding Process with Novel Biophysical and Chemical Approaches”, paper presented at Frontiers in Chemistry-A symposium dedicated to the memory of Prof. Ta-shue Chou, 中央研究院化學所周大紓講堂: 中央研究院化學所, 2012-02-21.
- Huang, J.-T., 2011, “Applying Novel Biophysical and Chemical Approaches in Co-translational Protein Folding Studies”, paper presented at 2011Annual Meeting of Chemical Society, National Tsing Hua University, Hsinchu: National Tsing Hua University, 2011-12-03 ~ 2011-12-04.
- Chia-Sui Sun, Ruei-Yu He, Yijuang Chern, Joseph J.-T. Huang*, 2011, “Characterize the aggregation process of the mHtt protein in the presence of chaperone”, paper presented at France-Taiwanesse Symposium on Neurobiology, IGBMC, France: IGBMC, 2011-11-28 ~ 2011-11-29.
- Huang, J.-T., 2011, “The Discovery of the Amyloid Fibrils from the C-terminal Fragments of TDP-43 in Amyotrophic Lateral Sclerosis”, paper presented at The 1st International Kyoto Conference on Organic Nanostructures, Kyoto University, Kyoto, Japan: Kyoto University, 2011-11-10.
- Huang, J.-T., 2011, “The Discovery of the Amyloid Fibrils from the C-terminal Fragments of TDP-43 in Amyotrophic Lateral Sclerosis”, paper presented at The 11th Tateshina Conference on Organic Chemistry, Nagoya, Japan: The 11th Tateshina Conference on Organic Chemistry, 2011-11-11 ~ 2011-11-13.
- Huang, J.-T., 2011, “Light up the folding zone within the ribosome tunnel”, paper presented at Sunney Chan Symposium 2011, Chou Ta-Shue Lecture Hall, Institute of Chemistry, Academia Sini: Institute of Chemistry, Academia Sinica, 2011-10-05.
- Huang, J.-T., 2011, “The impact of co-translational protein folding within the ribosome tunnel on chaperone recruitment”, paper presented at The 16th Biophysics Conference, National Dong Hwa University, Hua Lien: Biophysical Society of Taiwan R.O.C, 2011-05-18 ~ 2011-05-21.
- Huang, J.-T., 2010, “ Induction of amyloid fibrils by the TDP-43 fragments in ALS”, paper presented at 2010 Pacifichem Symposium, Honolulu, Hawaii, USA: Hawaii, USA, 2010-12-15 ~ 2010-12-20.
- Huang, J.-T., 2010, “ Explore the impact of ribosome tunnel on co-translational protein folding and chaperone recruitment”, paper presented at 2010 Annual meeting of Chinese Society, 台北: 台灣大學, 2010-12-04 ~ 2010-12-05.
- Joseph Jen-Tse Huang, 2009, “The Induction of TDP-43 C-terminal Fragment into Amyloid Fibrils by G294A Mutation in Amyotrophic Lateral Sclerosis”, p27 pages, paper presented at Frontier of Protein Aggregation and Neurodegenerative Diseases, 中央研究院生物化學研究所: 中央研究院生物化學研究所、中央研究院生物醫學研究所、中央研究院細胞與個體生物學研究所、中央研究院化學研究所、中央研究院基因體中心、中央研究院分子生物研究所, 2009-06-04.
- Ku-Feng Lin, Chia-Sui Sun, and Joseph Jen-Tse Huang* , 2009, “Study on Cotranslational Protein Folding within the Ribosomal Exit Tunnel”, paper presented at Joint International Conference of Biophysics and 14th Annual Conference of the Biophysical Society of ROC, 國立成功大學: Biophysical Society of ROC, 2009-06-24 ~ 2009-06-27.
- Allan K.-H. Chen, Ryan Y.-Y. Lin, Eva Z.-J. Xie, and Joseph J.-T. Huang*, 2009, “Mutation in TDP-43 C-terminal Fragment can Induce Beta-Amyloid Fibril Formation”, paper presented at Joint International Conference of Biophysics and 14th Annual Conference of the Biophysical Society of ROC, 國立成功大學: Biophysical Society of ROC, 2009-06-24 ~ 2009-06-27.
- 黃人則、陳長謙、林谷峰, 2012, “蛋白質摺疊:從核醣體到細胞功能的旅程”, 中央研究院週報-知識天地專刊, 1364期.
- Bipartite Molecules and Uses Thereof in Treating Diseases Associated with Abnormal Protein Aggregates
USA: US10,882,890 B2 2021 - 用以偵測類澱粉沉積蛋白之探針及方法 PROBES AND METHODS FOR DETECTING AMYLOIDOGENIC PROTEINS
Taiwan: I649091 2019 - 雙鏈分子(Bipartite)及其於治療異常蛋白聚集之用途
Taiwan: I587868 2017



